Uranyless Aqueux
Uranyless Aqueux
UranyLess Aqueous est une solution de contraste qui remplace l’acétate d’uranyle. Comme recommandé par Reynolds (1963), il est fortement conseillé de renforcer le contraste initial (dans notre cas, UranyLess) avec du citrate de plomb dans une atmosphère saturée en NaOH afin d’éviter toute contamination par le CO₂ atmosphérique.
Pour faciliter l’utilisation du citrate de plomb lors du contraste, il est conditionné dans des flacons AirLess (sans air et donc sans CO₂). Vous pouvez conserver ce flacon de 30 ml pendant une longue période sans risque de contamination au CO₂, un problème fréquent pour les microscopistes.
L’emballage en flacon AirLess de 30 ml permet de contraster plus de 1500 grilles.
Cet emballage est doublement efficace : il offre une longue durée de conservation et génère un minimum de déchets.
Pour l’utilisation de UranyLess Aqueous dans des dispositifs de contraste automatisés comme le EM Stain de Leica, UranyLess est disponible en flacon de 200 ml. Il convient de noter que UranyLess Aqueous est conditionné dans un flacon AirLess pour faciliter la distribution en gouttes uniquement, car il n’est pas affecté par l’air ni par la lumière.
Découvrez nos résultats !
levure
Préparation de l’échantillon selon le protocole suivant :
- Fixation standard au glutaraldéhyde – osmium, puis inclusion dans la résine Epon.
- Contraste avec UranyLess, suivi d’un contraste au citrate de plomb.
Voici quelques résultats de Jeannine Lherminier (INRA – Dijon).
Photographies prises au microscope électronique en transmission.
trématodes
Nous présentons ici quelques résultats de Yann Quilichini (Plateforme de microscopie de l’Université de Corse – Corte).
Préparation de l’échantillon selon le protocole suivant :
- Fixation standard au glutaraldéhyde et à l’osmium, puis inclusion dans la résine Spurr.
- Coupes minces – contraste avec UranyLess en solution aqueuse, suivi de citrate de plomb (selon Reynolds).
Photographies prises en microscopie électronique en transmission.
Polymersomes (Polymere)
Le laboratoire IMRCP à Toulouse, dirigé par Anne-Françoise Mingotaud, a testé UranyLess en comparaison avec l’acétate d’uranyle, à pH acide (4), qui semble perturber l’organisation de la structure moléculaire. Ils ont également comparé leurs observations au moyen de la cryo-MEB (microscopie électronique à balayage).
Observation par microscopie électronique à balayage en mode cryo et par coloration négative avec UranyLess.
Épiderme Reconstruit (humain)
Nous présentons les résultats d’Audrey Houcine (CMEAB Toulouse).
Préparation de l’échantillon selon le protocole suivant :
- Fixation standard au glutaraldéhyde, à l’osmium, puis inclusion dans Epon/Araldite.
- Réalisation de coupes ultrafines, avec un double contraste : d’abord Uranyless, puis citrate de plomb.
Photographies prises au microscope électronique en transmission Hitachi HT7700 par Audrey Houcine.
Muscle-Nerf (souris)
Préparation de l’échantillon selon le protocole suivant :
- Fixation standard avec glutaraldéhyde, osmium, Epon.
- Coupe ultra-fine, double contraste avec Uranyless (1 min) suivi de citrate de plomb (1 min).
Follicule Ovarien (souris).
Préparation de l’échantillon selon le protocole suivant :
- Fixation standard avec glutaraldéhyde, fixateur PFA, osmium, Epon.
- Coupe ultra-fine, double contraste avec Uranyless (1 min) suivi de citrate de plomb (1 min).
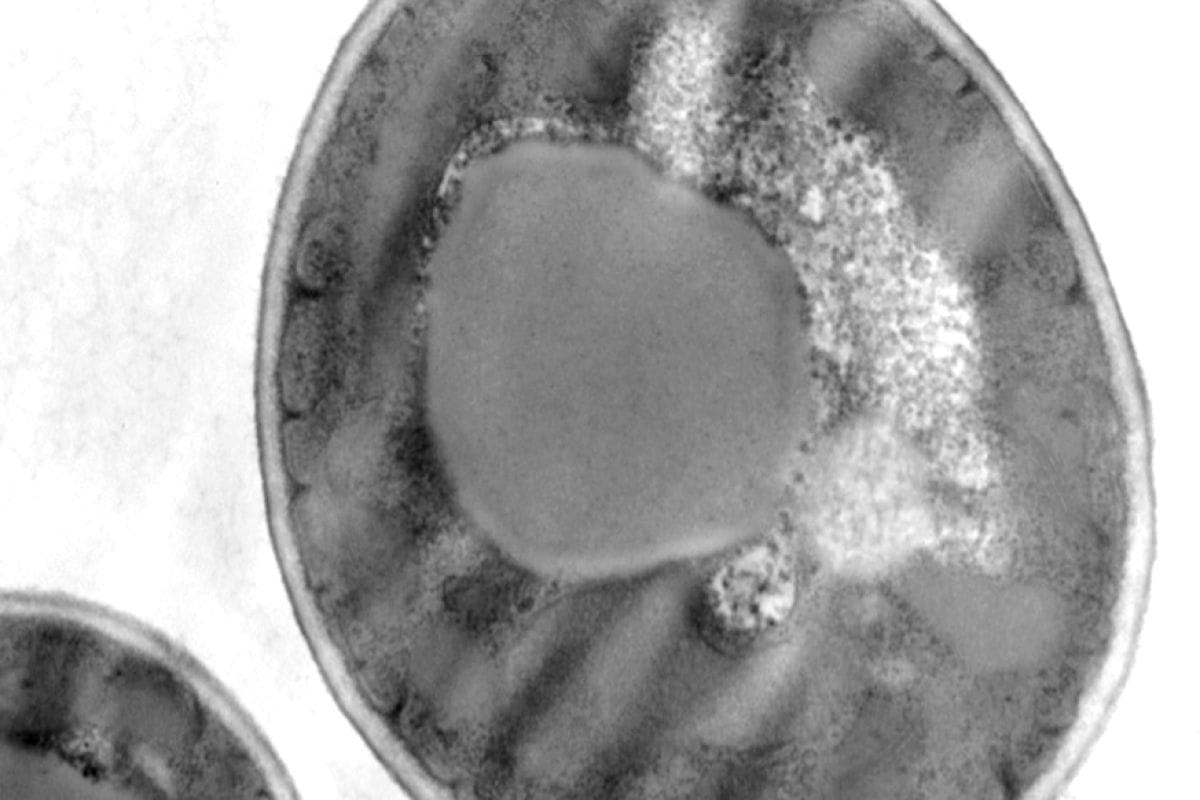
Rein (souris)
Rein (souris)
Préparation de l’échantillon selon le protocole suivant :
- Fixation classique avec PFA – Glutaraldéhyde, Osmium, Epon.
- Coupe ultra-fine – Contraste avec UranyLess (1 min) – Citrate de plomb (1 min).
Photos prises avec un microscope électronique en transmission Hitachi HT7700 par Nacer BENMERADI (R&D – Delta Microscopies – France).
Nacer Benmeradi (R&D - Deltamicroscopies, France).
Muscle cardiaque - (souris)
Préparation de l’échantillon selon le protocole suivant :
- Fixation classique avec glutaraldéhyde, osmium, Epon – Coupe ultra-fine.
- Coupes, double contraste avec Uranyless et citrate de plomb.
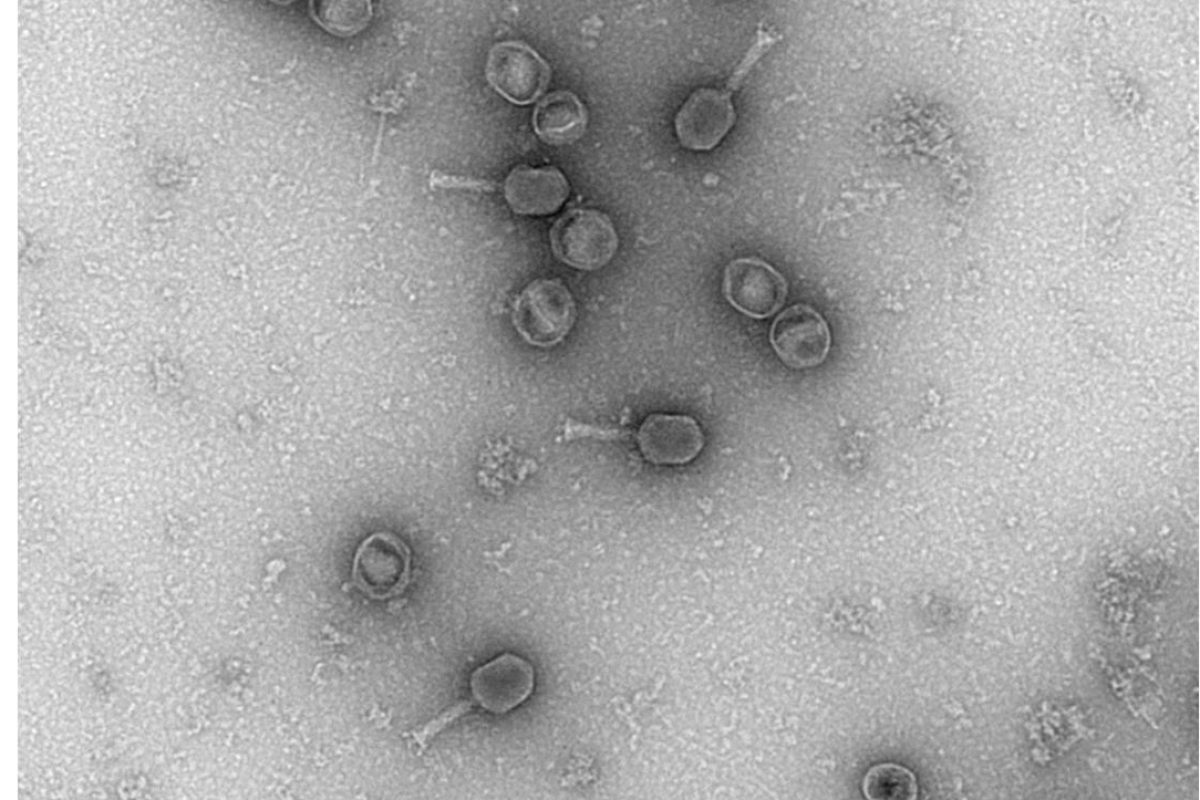
Phage T6
Préparation de l’échantillon selon le protocole suivant :
- Étalement du phage T6 sur une grille G300-Cu recouverte d’un film de formvar.
Ionisation de la grille : 1 min pour l’étalement de l’échantillon. - Toutes les photos : Nacer Benmeradi, PhD, Responsable R&D, Laboratoire Delta Microscopies, France.
Coupe transversale de bactérie (E. coli)
Préparation de l’échantillon selon le protocole suivant : Coupe transversale de bactérie.
- Fixation classique avec glutaraldéhyde, osmium, Epon.
- Coupe ultra-fine, double contraste avec Uranyless et citrate de plomb.
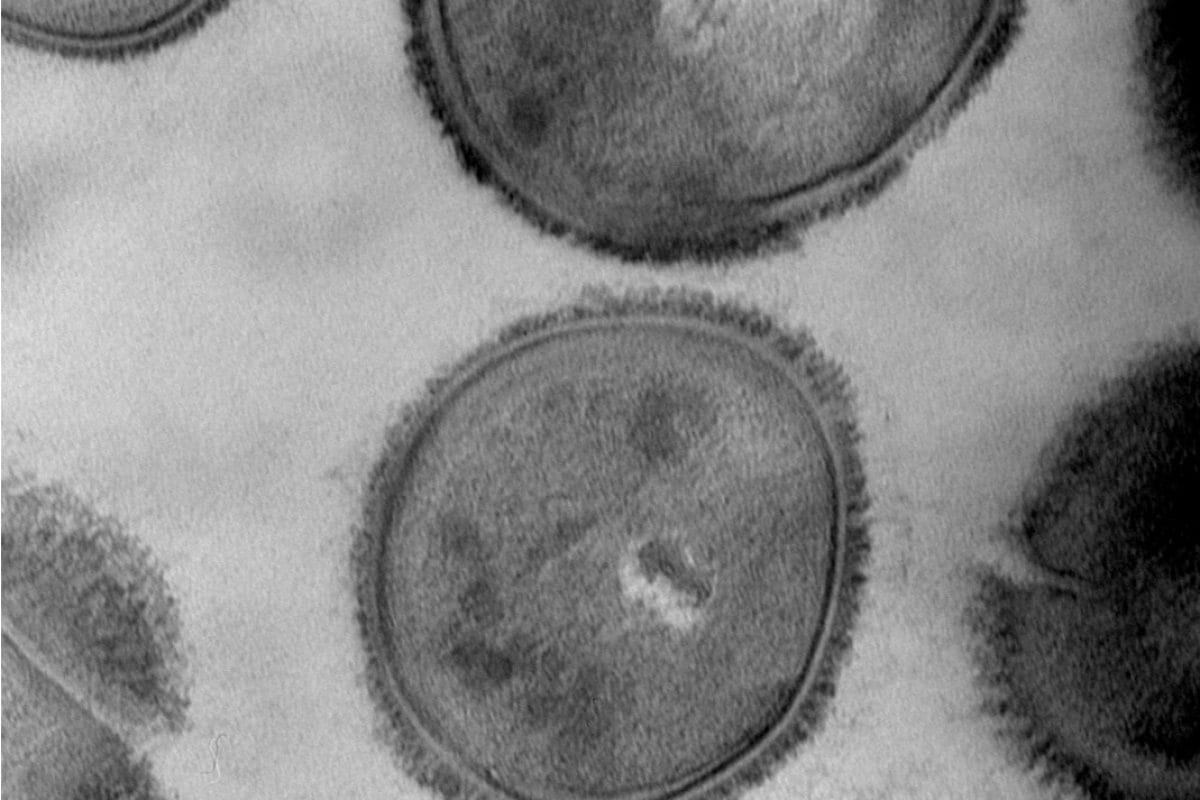
Photo : Christine Longin (INRA, Jouy-en-Josas, France).
Bacterie E-coli
- Coloration négative pendant 2 minutes avec Uranyless pour les bactéries telles que E. coli (adhérentes et invasives (ACSI) LF82) possédant des pili et des flagelles.
Sacculina crustacé (Intestin)
Préparation de l’échantillon selon le protocole suivant : Sacculina (petit crustacé parasite).
- Fixation classique avec glutaraldéhyde, osmium, inclusion en Epon.
- Coupes fines – Contraste à l’Uranyless aqueux à 60°C sur une plaque chauffante, sans post-coloration au citrate de plomb.
Intestine
- Fixation classique avec glutaraldéhyde, osmium, inclusion en Epon.
- Coupe ultra-fine – Contraste avec Uranyless et citrate de plomb.
Foie de souris et glande surrénale
Préparation de l’échantillon selon le protocole suivant : Foie de souris et gerbille du Sahara.
- Fixation classique avec glutaraldéhyde, osmium, Epon.
- Coupe ultra-fine, double contraste avec Uranyless et citrate de plomb.
Glande surrénale de gerbille du Sahara
- Fixation classique avec glutaraldéhyde, osmium, Epon.
- Coupe ultra-fine, double contraste avec Uranyless et citrate de plomb.
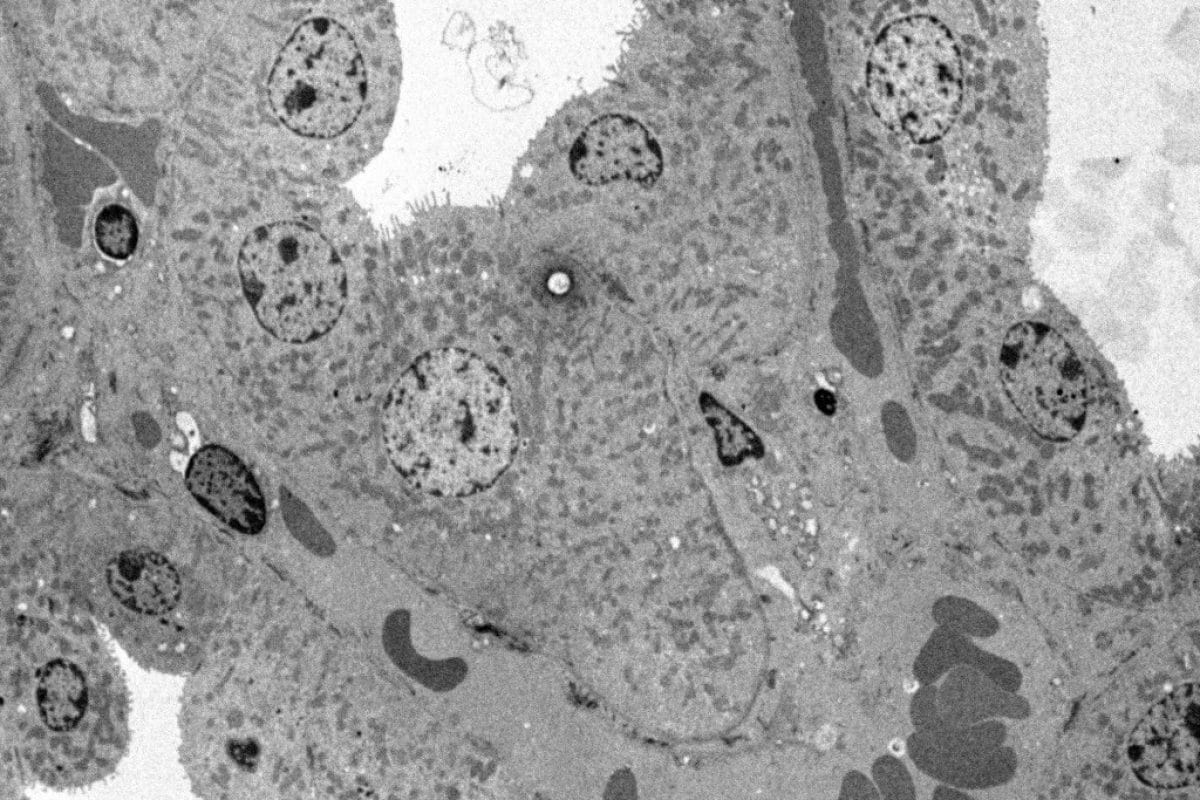
Cellules en culture HeLa
Préparation de l’échantillon selon le protocole suivant :
- Fixation classique avec PFA – Glutaraldéhyde, Osmium, Epon.
- Coupe ultra-fine – Contraste avec UranyLess – Citrate de plomb.
Photos prises avec un microscope électronique en transmission Hitachi HT7700 par Nacer BENMERADI (R&D – Delta Microscopies – France).
Accessoires recommandés
Voir Aussi
Navigation
Contact
22b route de Saint Ybars 31190
Mauressac France
+(33) 5 61 73 60 14
info@deltamicroscopies.com